Die Wasserzusammensetzung in Deinem Aquarium ist ein weiterer wichtiger Faktor für gesunde Fische, Pflanzen und Wirbellose. Schließlich stehen sie mit ihrem ganzen Körper permanent in Kontakt mit den Stoffen, die im Wasser gelöst sind. Schon kleine Abweichungen können bei Deinen Schützlingen unnötigen Stress oder gar Krankheiten auslösen. Deshalb solltest du die wichtigsten Wasserwerte kennen, regelmäßig messen und bei Bedarf anpassen. Im Fachhandel findest du leicht zu bedienende Test-Sets, mit denen sich die Wasserchemie zuverlässig bestimmen lässt.
Härte: GH und KH verstehen
Unter Härte versteht man die Menge der im Wasser gelösten Calcium- und Magnesiumverbindungen. Sie wird in zwei Formen unterschieden:
- Gesamthärte (GH): Sie beschreibt die Summe aller Calcium- und Magnesiumionen im Wasser.
- Karbonathärte (KH): Sie bezeichnet den Anteil dieser Ionen, die in Verbindung mit Kohlensäure (als Karbonate) vorkommen.
In den meisten Fällen liegt die KH etwas niedriger als die GH. Beide Werte haben direkten Einfluss auf die Wasserqualität und sind entscheidend für die Lebensbedingungen der Fische und Pflanzen in Deinem Becken.
Zusammengefasst ist die Härte folgendermaßen definiert:
| unter 7°: | weiches Wasser |
| 7-14°: | mittelhartes Wasser |
| 14-21°: | hartes Wasser |
| über 21°: | sehr hartes Wasser |
Unser Tipp: Viele Aquarien werden mit Leitungswasser betrieben. Je nachdem, durch welche Gesteinsschichten das Wasser in Deiner Region geflossen ist, kann es härter oder weicher sein. Deshalb lohnt sich ein Blick auf Deine lokalen Wasserwerte. Die Härte beeinflusst auch die Osmose im Körper der Tiere – also den Austausch von Wasser und gelösten Stoffen durch Zellwände. Fische und Wirbellose haben sich an bestimmte Härtebereiche angepasst, daher solltest du Dich immer am natürlichen Lebensraum Deiner Pfleglinge orientieren.
Leitwert: Wie salzig ist Dein Wasser?
Ein weiterer wichtiger Parameter ist der Leitwert. Er gibt an, wie viele gelöste Salze sich im Wasser befinden – und damit, wie gut es Strom leitet. Gemessen wird in µS/cm (Mikrosiemens pro Zentimeter). Grundsätzlich gilt: je höher der Salzgehalt, desto höher der Leitwert. Neben Calcium- und Magnesiumsalzen können auch Nitrat, Phosphat oder zugesetztes Kochsalz den Wert beeinflussen.
Zur Orientierung ein paar typische Beispiele:
- Destilliertes Wasser: ca. 1 µS/cm
- Osmosewasser: 10 bis 30 µS/cm
- Regenwasser (ländlich): ca. 30 µS/cm
- Leitungswasser in Deutschland: meist 100 bis 1000 µS/cm
- Meerwasser: ca. 42.000 µS/cm
Extra-Tipp: Ein Aquarien-Leitwertmessgerät (Konduktometer) ist ein praktisches Werkzeug, um sich selbst ganz einfach ein Bild zu machen.
Warum die Wasserzusammensetzung im Aquarium so wichtig ist
Die richtige Wasserzusammensetzung im Aquarium sorgt dafür, dass Deine Fische gesund bleiben, Pflanzen kräftig wachsen und sich Wirbellose wohlfühlen. Abweichungen von den optimalen Werten können unnötig Stress verursachen und Krankheiten begünstigen. Sehr wichtig: Prüfe regelmäßig Härte, Leitwert und pH-Wert – und passe die Bedingungen an die Bedürfnisse Deiner Tiere an. Mit etwas Routine wird das schnell zum selbstverständlichen Teil Deines Alltags, fast wie Zähneputzen.
Der pH-Wert einfach erklärt
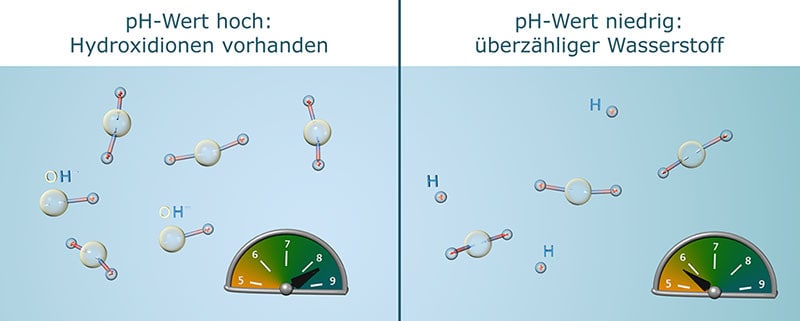
Der pH-Wert zeigt an, ob Wasser sauer, neutral oder basisch (alkalisch) ist. Die Skala reicht dabei von 0 (sehr sauer) bis 14 (sehr basisch). Der Neutralpunkt liegt bei 7. Wichtig zu wissen: Schon kleine Veränderungen haben eine große Wirkung. Eine pH-Verschiebung um nur eine Stufe bedeutet eine Verzehnfachung der Konzentration der verantwortlichen Ionen. Zwei Stufen entsprechen bereits dem Hundertfachen, drei Stufen sogar dem Tausendfachen.
Welche Ionen bestimmen den pH-Wert?
Der pH-Wert hängt direkt vom Verhältnis zweier Teilchen im Wasser ab:
- Wasserstoff-Ionen (H⁺) → machen das Wasser sauer.
- Hydroxid-Ionen (OH⁻) → machen das Wasser basisch.
Je mehr H⁺-Ionen im Wasser sind, desto niedriger ist der pH-Wert – das Wasser ist sauer.
Gibt es dagegen mehr OH⁻-Ionen, steigt der pH-Wert an – das Wasser wird basisch.
| Gut zu wissen: Der Name „Sauerstoff“ beruht auf einer alten Fehlannahme. Sauerstoff ist eigentlich basisch und nicht sauer. |
Hydroxidionen (OH⁻) entstehen, wenn einem Wassermolekül (H₂O) ein Wasserstoffatom fehlt. Merke: Der pH-Wert ist ein direkter Hinweis darauf, wie viel „überschüssiger“ Wasserstoff oder Hydroxid im Wasser vorhanden ist. Damit der pH-Wert im Aquarium stabil bleibt, solltest du regelmäßig messen und auf die Bedürfnisse Deiner Fische und Pflanzen achten.
Die meisten Süßwasserfische und Aquarienpflanzen fühlen sich in einem Bereich von pH 6 bis 8 wohl. Innerhalb dieser Spanne sind sie anpassungsfähig und können gesund leben.
Es gibt jedoch Ausnahmen:
- Einige Spezialisten bevorzugen extremere Werte um pH 5 (stark sauer) oder pH 9 (sehr basisch).
- Meerwasserfische benötigen einen stabilen pH-Wert zwischen 8,2 und 8,4, da schon kleine Abweichungen Stress auslösen können.
Herkunft bestimmt die Ansprüche
Nicht alle Arten haben die gleichen Bedürfnisse. Je nach Herkunft unterscheiden sich die bevorzugten Wasserwerte deutlich:
- Amazonasfische wie Skalare oder Neonfische kommen oft aus weichen, sauren Gewässern und mögen pH-Werte unter 7.
- Fische aus afrikanischen Seen wie Malawi- oder Tanganjikasee bevorzugen eher neutral bis leicht basisch.
Auch Pflanzen haben ähnliche Vorlieben: Manche gedeihen besser in weichem, leicht saurem Wasser, andere bevorzugen härteres, basisches Wasser.
Wodurch wird der pH-Wert im Aquarium beeinflusst?
In natürlichen Gewässern – und damit auch im Aquarium – wird der pH-Wert hauptsächlich durch das Zusammenspiel von Karbonathärte (KH) und CO₂-Gehalt bestimmt.
Diese beiden Faktoren bilden eine Art „Puffer-System“:
- Hohe KH sorgt für stabile pH-Werte, die sich nur schwer verändern lassen.
- Viel CO₂ senkt den pH-Wert.
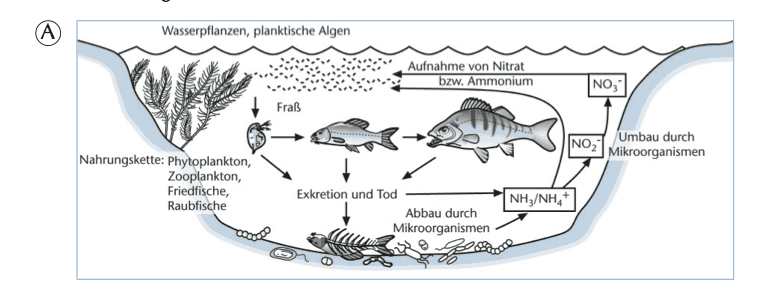
Stickstoffverbindungen im Aquarium
Stickstoff (N) ist ein lebenswichtiges Element, da er Bestandteil von Proteinen ist. Beim Abbau dieser Proteine entsteht im Aquarium Ammonium (NH₄⁺). Hauptquelle dafür sind die Verdauungsprozesse von Fischen und anderen Wassertieren. Sie können Proteine nur bis zu Ammonium abbauen und geben dieses anschließend über ihre Ausscheidungen ans Wasser ab. In der Natur wird Ammonium fast vollständig von Pflanzen und Algen aufgenommen und dort als Nährstoff weiterverwendet. Ein kleiner Teil wird durch Bakterien unter Sauerstoffverbrauch zu Nitrat (NO₃⁻) umgewandelt, das wiederum Pflanzen als Nährstoff dient. Dieser Stickstoffkreislauf sorgt dafür, dass sich keine giftigen Zwischenprodukte anreichern. Im Aquarium läuft dieser Prozess jedoch nicht so reibungslos, weil die Besatzdichte viel höher ist als in natürlichen Gewässern. Dadurch entsteht mehr Ammonium, als die Pflanzen aufnehmen können. Hier übernehmen nitrifizierende Bakterien im Filter die Hauptarbeit.
Wie Ammonium zu Nitrit und Nitrat wird
Die Umwandlung geschieht in zwei Schritten:
- Nitrosomonas-Bakterien oxidieren Ammonium zu Nitrit (NO₂⁻).
- Nitrobacter-Bakterien wandeln Nitrit weiter zu Nitrat (NO₃⁻).
Während Ammonium selbst nur mäßig problematisch ist, kann es je nach pH-Wert in das hochgiftige Ammoniak (NH₃) übergehen. Generell gilt: Je höher der pH-Wert, desto größer der Anteil an giftigem Ammoniak.
Nitrit ist besonders gefährlich:
- Ab 0,5 mg/l wird es kritisch für Fische.
- Ab 2,0 mg/l wirkt es tödlich.
Die Einlaufphase und Bakterienkulturen
Damit das Aquarium stabil läuft, müssen sich die notwendigen Bakterienkulturen erst entwickeln. Diese Phase nennt man Einlaufphase. Du kannst sie auf verschiedene Arten unterstützen:
- durch die Zugabe von Mulm aus einem eingefahrenen Aquarium,
- oder mit speziellen Bakterienpräparaten aus dem Handel.
Erhöhte Ammonium- oder Nitritwerte zeigen immer, dass die Bakterienpopulation gestört ist – sei es durch Vergiftung (z. B. Medikamente) oder durch ein zu junges Aquarium.
Nitrat – weniger gefährlich, aber problematisch
Im Gegensatz zu Ammonium und Nitrit ist Nitrat für Fische nicht direkt giftig. Trotzdem solltest du den Wert niedrig halten, da ab etwa 50 mg/l das Algenwachstum stark gefördert wird.
Filterleistung und Wasserwechsel
Ein guter Filter ist der Schlüssel zu einem stabilen Stickstoffkreislauf. Dabei gilt:
- Je größer die Oberfläche des Filtermaterials, desto mehr Bakterien können sich ansiedeln.
- Das Wasser sollte den Filter gleichmäßig und nicht zu schnell durchströmen, damit die Bakterien optimal arbeiten können.
Überschüssige Stickstoffverbindungen entfernst du zuverlässig nur über regelmäßige Teilwasserwechsel.
Phosphor- und Siliciumverbindungen
Phosphat im Aquarium
Phosphor (Phosphat, PO₄³⁻) ist ein wichtiger Nährstoff und erfüllt zahlreiche Aufgaben im Stoffwechsel:
- Energieübertragung in Zellen,
- Knochenaufbau bei Fischen,
- Pflanzenernährung.
In der Natur sind Phosphatwerte extrem niedrig (0,001–0,01 mg/l). Im Aquarium kommt es jedoch leicht zu einer Phosphatflut, z. B. durch:
- Überfütterung,
- unsachgemäß aufgetautes Frostfutter,
- phosphathaltige Produkte.
Ein Überangebot nützt Pflanzen wenig, aber Algen profitieren massiv davon. Das Redfield-Verhältnis gibt das ideale Verhältnis von Stickstoff zu Phosphor an:
- 16:1 im Original,
- auf Nitrat und Phosphat umgerechnet etwa 23:1.
Hältst du Dich an dieses Verhältnis, beugst du übermäßigem Algenwachstum vor.
Silikat im Aquarium
Silikat (SiO₂) stammt aus der Verwitterung von Gesteinen und gelangt ins Grund- und Leitungswasser. Je nach Region können Gehalte von bis zu 40 mg/l vorkommen.
Im Aquarium ist Silikat besonders für Kieselalgen (Diatomeen) wichtig. Sie bilden nach Neueinrichtungen oft braune Beläge auf Pflanzen und Deko. Diese verschwinden normalerweise von selbst, sobald das Aquarium eingefahren ist und sich Konkurrenzalgen durchsetzen.
Schwermetalle im Aquarium
Schwermetalle im Wasser können schon in kleinsten Mengen giftig wirken. Zwar ist das Risiko durch Leitungswasser in Europa dank strenger Vorschriften gering, doch es gibt Gefahrenquellen:
- Kupferrohre oder Warmwasserboiler können Kupfer ins Wasser abgeben.
- Bleibänder an Pflanzen gehören nicht ins Aquarium.
Mit der Zeit bilden sich Schutzschichten (z. B. Kalk in Rohren), die Schwermetalle binden. Doch durch Änderungen der Wasserchemie (pH-Wert, CO₂-Anlage) können sie sich plötzlich lösen und eine akute Vergiftung verursachen.
Das Zusammenspiel von pH, KH und CO₂
Damit Pflanzen, Tiere und Mikroorganismen im Aquarium gesund bleiben, spielen drei Werte eine wichtige Rolle: der pH-Wert, die Karbonathärte (KH) und das Kohlendioxid (CO₂). Diese Werte hängen eng zusammen – wenn sich einer verändert, passen sich die anderen automatisch an.
Grundlagen
- Karbonathärte (KH): Sie besteht u. a. aus Calciumhydrogencarbonat (Formel: Ca(HCO₃)₂). Vereinfacht gesagt setzt sie sich aus Kalzium, Wasserstoff, Kohlenstoff und Sauerstoff zusammen.
- pH-Wert: Er zeigt an, ob das Wasser eher sauer (pH unter 7, viele H⁺-Ionen) oder basisch (pH über 7, mehr OH⁻-Ionen) ist.
- CO₂: Kommt aus der Luft ins Wasser, wird von Fischen und beim Abbau organischer Stoffe produziert und ist für Pflanzen lebenswichtig.
KH, pH und CO₂ in Balance halten
Bestimme zuerst die KH (z. B. mit einem Tropf-Test) und überlege, wie viel CO₂ du im Becken haben möchtest:
- wenig: 3–5 mg/l
- mittel: 6–14 mg/l
- hoch: 15–30 mg/l
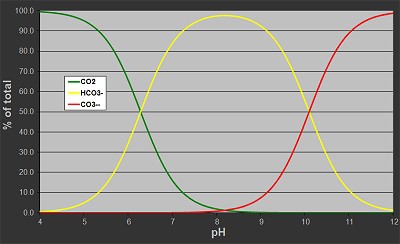
Beispiel: Hat Dein Wasser eine KH von 12 °dKH, sollte der pH-Wert für ein gutes Gleichgewicht zwischen 7,5 und 7,8 liegen. Im Wasser laufen dabei Umwandlungen ab:
- bei niedrigem pH → Karbonate und Bikarbonate werden zu CO₂,
- bei neutralem pH → hauptsächlich Bikarbonate,
- bei hohem pH → mehr Karbonate.
Über den pH-Wert lässt sich also indirekt auch der CO₂-Gehalt steuern.
Typische Szenarien
- Zu wenig CO₂: Pflanzen hungern, weil sie nicht genug Kohlenstoff aufnehmen können.
- Mit CO₂-Anlage: Erhöht sich der CO₂-Gehalt, sinkt der pH-Wert automatisch.
- Hohe KH-Werte: Ab etwa 8 °dKH wird es schwer, den pH mit CO₂ abzusenken. In solchen Fällen ist es besser, die KH auf etwa 4 °dKH zu reduzieren – sonst drohen den Fischen Stress oder gar CO₂-Vergiftung.
Auch mit Säuren lässt sich der pH-Wert senken, das ist aber riskant und sollte nur mit großer Vorsicht erfolgen. KH, pH und CO2 stehen immer in einem festen Verhältnis zueinander, sie diese Tabelle:
dKH
| pH | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
| 6.2 | 42 | 83 | 123 | 166 | 207 | 245 | 290 | 331 | 373 |
| 6.3 | 33 | 66 | 97 | 132 | 164 | 195 | 230 | 263 | 297 |
| 6.4 | 27 | 52 | 77 | 105 | 131 | 155 | 183 | 209 | 236 |
| 6.5 | 21 | 42 | 61 | 83 | 104 | 123 | 145 | 166 | 187 |
| 6.6 | 17 | 33 | 49 | 66 | 82 | 98 | 115 | 132 | 149 |
| 6.7 | 13 | 26 | 39 | 52 | 65 | 78 | 92 | 105 | 118 |
| 6.8 | 11 | 21 | 31 | 42 | 52 | 62 | 73 | 83 | 94 |
| 6.9 | 8 | 17 | 24 | 33 | 41 | 49 | 58 | 66 | 74 |
| 7.0 | 7 | 13 | 19 | 26 | 33 | 39 | 46 | 52 | 59 |
| 7.1 | 5 | 10 | 15 | 21 | 26 | 31 | 36 | 42 | 47 |
| 7.2 | 4 | 8 | 12 | 17 | 21 | 24 | 29 | 33 | 37 |
| 7.3 | 3 | 7 | 10 | 13 | 16 | 19 | 23 | 26 | 30 |
| 7.4 | 3 | 5 | 8 | 10 | 13 | 15 | 18 | 21 | 23 |
| 7.5 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 17 | 19 |
| 7.6 | 2 | 3 | 5 | 7 | 8 | 10 | 11 | 13 | 15 |
| 7.7 | 1 | 3 | 4 | 5 | 7 | 8 | 9 | 10 | 12 |
| 7.8 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 7.9 | 1 | 2 | 2 | 3 | 4 | 5 | 6 | 7 | 7 |
| 8.0 | 1 | 1 | 2 | 3 | 3 | 4 | 5 | 5 | 6 |
| 8.1 | 1 | 1 | 1 | 2 | 3 | 3 | 4 | 4 | 5 |
| 8.2 | 0 | 1 | 1 | 2 | 2 | 2 | 3 | 3 | 4 |
Verwendung der Tabelle
- Bestimmen zunächst die Karbonathärte (typischerweise mit Hilfe eines Tropfsets).
- Legen den gewünschten CO2-Pegel fest (gering: 3 – 5 mg CO2/l; medium: 6 – 14 mg CO2/l, viel: 15 – 30 mg CO2/l).
- Wenn dein Wasser z. B. eine Karbonathärte von 12 °dKH hat, muss die CO2-Zufuhr justiert werden, bis der pH-Wert zwischen 7,5 und 7,8 liegt.
Auch mit Säuren lässt sich der pH-Wert senken, das ist aber riskant und sollte nur mit großer Vorsicht erfolgen.
Wasserhärte anpassen
- Härte erhöhen: z. B. durch Filterung über Korallenbruch oder mit Aufhärtern aus dem Handel.
- Härte senken: geht fast nur über Ionenaustauscher oder eine Umkehrosmose-Anlage.
Ionenaustauscher: Harze tauschen bestimmte Ionen aus, wodurch die Härte sinkt. Nach einer gewissen Zeit müssen die Harze regeneriert werden (z. B. mit Salzsäure).
Umkehrosmose: Leitungswasser wird durch eine feine Membran gedrückt. Dabei bleiben Salze zurück, und man erhält weiches Wasser (Permeat). Allerdings geht dabei ein Teil des Wassers als Konzentrat in den Abfluss. Eine Osmoseanlage lohnt sich besonders bei regelmäßigem Wasserbedarf.
Pflanzenwachstum und CO₂
CO₂ ist für Aquarienpflanzen ein wichtiger Nährstoff. Wenn du es dosiert zuführst, wachsen die Pflanzen kräftiger und setzen mehr Sauerstoff (O₂) frei – davon profitieren auch Deine Fische.
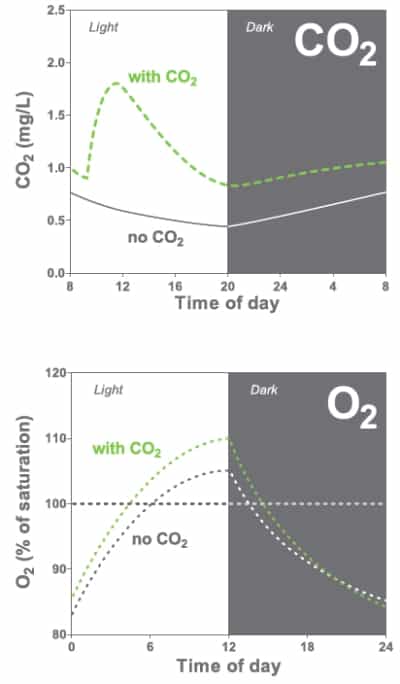
Biogene Entkalkung
Wenn zu wenig CO₂ vorhanden ist (z. B. bei hohem pH-Wert), fällt Kalk als Belag auf den Pflanzen aus. Manche Pflanzen ziehen sich dann Kohlenstoff direkt aus dem Hydrogenkarbonat. Dabei entsteht aber OH⁻, was den pH-Wert weiter steigen lässt, während die KH sinkt. Wird die KH zu niedrig, fehlt der „Puffer“, der Schwankungen im pH-Wert abfängt – dann kann es zu gefährlichen pH-Stürzen kommen. Kalkablagerungen sind also ein Warnsignal, dass du die Werte genauer im Auge behalten solltest.
Quellen: JBL-Broschüre „Biotopgerechtes Aquarienwasser“, Wikipedia, ZZF, aquamax
Bilder: Tropica, Birthe Jabs
Podcasts zum Thema
