Das Verhalten der für uns wichtigen Gase CO2 (Kohlenstoffdioxid) und O2 (Sauerstoff).
In Wasser ist eine bestimmte Menge dieser Gase gelöst. Wichtig zu wissen: Gase versuchen immer, sich möglichst gleichmäßig zu verteilen (Siehe: Diffusion) . Wie viel Gas im Wasser ist, kommt allein auf die Wasserparameter an. Bei Sauerstoff hauptsächlich auf die Temperatur, und zwar je wärmer desto weniger. Die Sättigung ist bei 20°C 9,1 mg pro 1 Liter Wasser, bei 25° nur noch 8 mg / Liter.
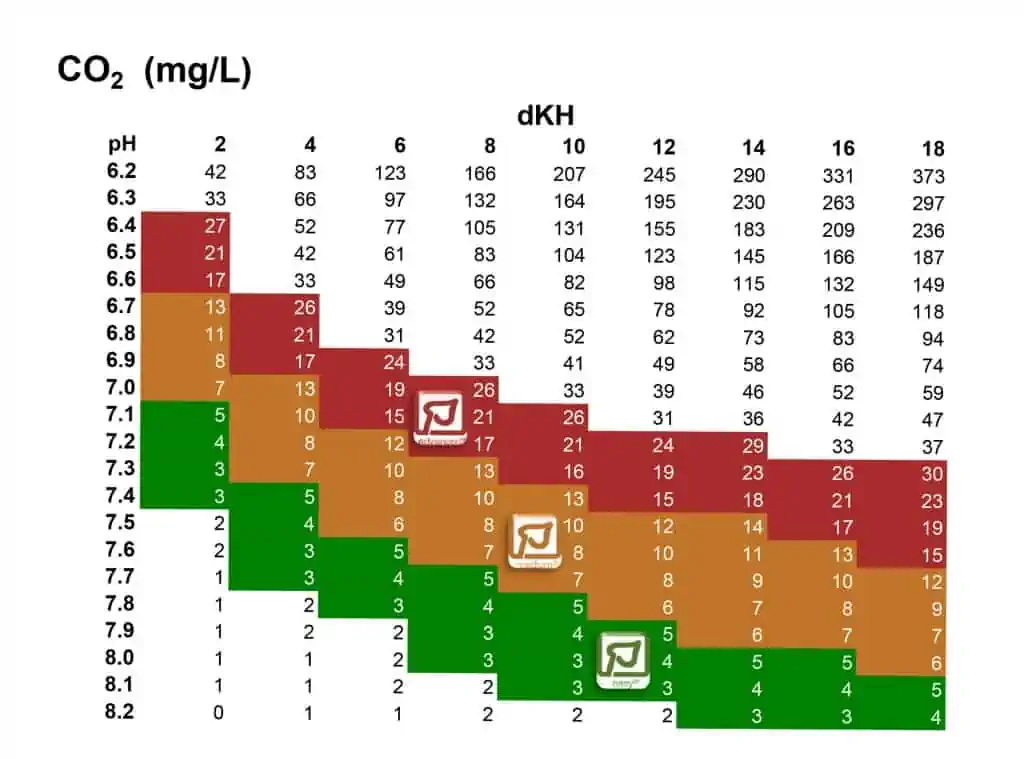
Der CO2 Gehalt wird durch den pH Wert und die Karbonathärte bestimmt. Da gibt es Tabellen, aus denen man das ablesen kann.

CO2 und O2 haben tatsächlich nichts miteinander zu tun. Das heißt auch, CO2 kann keinen Sauerstoff austreiben. Wie es zu der Internetweisheit kam, erkläre ich später noch.
Nehmen wir als Beispiel Wasser mit einem pH Wert von 7 und einer KH von 8. Wir haben also laut Tabelle 25 mg CO2 in einem Liter Wasser und bei 25°C 8 mg Sauerstoff. Das ist sozusagen der „bequeme“ Zustand für das Wasser, genau diese Menge der beiden Gase kann es gut „tragen“. Es versucht also, diesen Zustand herzustellen.
Das Werkzeug dafür ist die Wasseroberfläche. Der Kohlenstoffdioxidgehalt auf deren anderer Seite, der Luft, ist 0,039 % und der Sauerstoffgehalt in der Luft 20,94 %. Im Verhältnis haben wir in der Luft also viel weniger CO2 als im Wasser und umgekehrt viel mehr Sauerstoff in der Luft. An der Oberfläche kann also CO2 das Wasser verlassen (es „diffundiert“) und O2 aufgenommen werden.
Welche Einflüsse können jetzt auf unseren Gashaushalt einwirken?
Pflanzen produzieren per Photosynthese Sauerstoff. Wenn es dunkel ist, verbrauchen sie aber auch Sauerstoff und geben CO2 ab.
Fische verbrauchen bekanntermaßen Sauerstoff und atmen CO2 aus (genau wie wir).
Während der Nitrifikation, also dem Abbau organischer Substanzen, wird Sauerstoff verbraucht.
Mittels CO2 Anlage führen wir dem Wasser extra CO2 zu, damit die Pflanzen tagsüber mehr Photosynthese betreiben können – sie bestehen aus Kohlenstoff, den sie aus dem Wasser aufnehmen, um zu wachsen.
Bei Überdruck löst sich mehr Gas im Wasser.
Temperatur beeinfluss wie erwähnt den Sauerstoffgehalt.
Bis auf Temperatur und Druck ändern sich all diese Einflüsse nur sehr langsam. Schauen wir uns mal den Fall Abbau organischer Substanzen an.
Der Mulm liegt auf dem Boden des Aquariums. Hier wird von den Bakterien beim Abbau Sauerstoff verbraucht. Dieser muss aber von der Oberfläche, wo er aus der sauerstoffreichen Luft herein diffundiert, „nachrücken“, da steht der Sauerstoff in der Atmosphäre ja praktisch schon Schlange. Nur woher soll der wissen, dass unten ein Mangel herrscht? Direkt unter der Oberfläche ist der Sauerstoffgehalt ja hoch genug.
Nur die Sauerstoffmoleküle, die weiter unten unterwegs sind, „bemerken“ jetzt den Mangel und „eilen“ weiter runter. Verständlich, dass „eilen“ bei einem so kleinen Teil etwas dauert. Und so setzt sich praktisch der ganze Sauerstoff ganz allmählich in Bewegung nach unten, und erst wenn an der Wasseroberfläche wieder Platz frei ist, kann der Sauerstoff aus der Atmosphäre dort „zusteigen“. Das System ist also relativ träge.
Deshalb funktioniert auch unsere CO2 Anlage. Man könnte ja meinen, wenn das Wasser mehr CO2 eigentlich gar nicht fassen kann, wirft es das überschüssige CO2 direkt wieder oben raus. Aber bis dahin muss das CO2 einen weiten Weg zurücklegen, das geht nicht so schnell. Also muss das Wasser, auch wenn’s ihm eigentlich zu viel ist, es trotzdem tragen. Es passt sich an das Mehr an CO2 an – der pH Wert verändert sich so, dass es das CO2 wieder gut tragen kann.
Insgesamt ist das ganze recht stabil. Tagsüber sättigen die Pflanzen das Wasser mit Sauerstoff. Davon sehen wir nichts – gelöste Gase sind unsichtbar. Aber in dem Moment wo das Wasser „satt“ ist, weiß der Sauerstoff nicht mehr wohin, drängt sich zusammen und wird wieder zu atmosphärischem Gas. Nämlich den Blasen, die wir dann aufsteigen sehen. Sprich, wenn wir Blasen aufsteigen sehen, ist das Wasser schon randvoll mit Sauerstoff.
Wenn es dunkel wird, geht der Sauerstoffgehalt runter, weil Fische, Pflanzen und Bakterien alle Sauerstoff verbrauchen. Der CO2 Gehalt steigt, weil allesamt CO2 ausatmen. Deshalb verändert sich jetzt auch wieder der pH Wert, denn der muss ja dem CO2 Gehalt folgen. CO2 beginnt an der Oberfläche auszusteigen, während Sauerstoff von dort rein kommt – aber wie erwähnt dauert das alles etwas.
Normalerweise reicht der Sauerstoffvorrat aus, um alle Lebewesen über die Nacht zu bringen. Wenn das Becken aber dicht besetzt und oder bepflanzt ist, kann es sein, dass der Sauerstoff irgendwann knapp wird. (Wer gut aufgepasst hat, kann jetzt sagen, warum eine Absenkung der Temperatur nachts nicht verkehrt ist 😉 )
In dem Fall schließt man eine Luftpumpe an. Aber was genau passiert dann? Im Wasser herrscht Sauerstoffmangel, den das Wasser eigentlich bestrebt ist aufzuheben, aber die Wasseroberfläche als „Nadelöhr“ ist zu klein und zu weit weg dafür. Wenn man jetzt also von unten viele kleine Blasen durchs Wasser steigen lässt, haben die zusammen eine riesige Oberfläche und in ihnen steckt die volle Ladung Sauerstoff aus der Luft. Zudem ist der Druck in niedrigen Wasserschichten hoch und das Gas wird praktisch aus den Blasen raus ins Wasser gedrückt. Das Zuviel an CO2 hingegen schlüpft in die Blasen hinein, in denen ja wenig CO2 ist, ganz wie in der Atmosphäre. Bewegte Wasseroberfläche und Umwälzung machen das ganze nur in „klein“, sie helfen dem Sauerstoff bei der Reise, holen den frischen von oben ab und wirbeln ihn im Aquarium herum an die Stellen, wo er gebraucht wird, und macht damit die Oberfläche frei für neuen Sauerstoff zum Eintreten aus der Luft.
Und hier kommt unsere Internetweisheit ins Spiel. Ja CO2 wird weniger und O2 mehr, aber die beeinflussen sich nicht gegenseitig, sondern werden beide separat von der Sättigung kontrolliert. Das eine vom anderen „ausgetrieben“ wird also nicht. „Belüftung“ dient schlicht als Expresstransport für die Gase.